Struktur und Wirkungsweise von Gfat-1 aufgeklärt
Nächste Schritte auf dem Weg zum Medikament
Im Alter häuft sich immer mehr Proteinschrott in Zellen an, Proteine „verklumpen“ und das Risiko an Krankheiten wie Alzheimer oder Parkinson zu erkranken steigt. Forschende vom Max-Planck-Institut für Biologie des Alterns fanden vor sechs Jahren im Fadenwurm Caenorhabditis elegans ein Protein, genannt GFAT-1, welches den Abbau von geschädigten Proteinen aktiviert und ein interessantes Ziel für die Entwicklung von Medikamenten ist. Jetzt hat die Forschungsgruppe von Martin Denzel weitere wichtige Schritte geschafft: Sie konnten die Struktur des Proteins aufklären und zeigen, dass das Protein auch in Säugerzellen wichtig für den Abbau von Proteinaggregaten ist.
Wenn Forschende eine Entdeckung publizieren, bedeutet das nicht, dass die Arbeit an dem Projekt abgeschlossen ist. Häufig fängt sie dann erst richtig an. Auch Martin Denzel und sein Forschungsteam hatten, nachdem sie die Wirkung von GFAT-1 im Fadenwurm aufgeklärt hatten, noch offene Fragen. „Langfristig gesehen, wollen wir ein Medikament finden, das hilft neurodegenerativen Erkrankungen vorzubeugen. Dafür suchen wir nach Wirkstoffen, die die Funktion von GFAT-1 verbessern. Es war aber noch vollkommen unklar wie GFAT-1 genau aktiviert wird und ob GFAT-1 auch in anderen Organismen eine Rolle spielt“, erklärt Denzel.
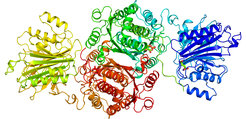
Kristallstruktur von GFAT-1
Um die Struktur von GFAT-1 aufzuklären, nutzten die Forschenden in Denzels Labor in Zusammenarbeit mit Ulrich Baumann an der Universität zu Köln, die Proteinkristallisation. Bei dieser Methode werden Proteine mit intensivem Röntgenlicht bestrahlt und so deren Aufbau und Funktionsweise entschlüsselt. Sabine Ruegenberg konnte das Protein in der kompletten Länge analysieren und zeigen wie die Aktivierung des Proteins funktioniert. „Das ist ein Durchbruch. Jetzt können wir viel zielgerichteter nach Wirkstoffen suchen“, freut sich Denzel.
Proteinaggregate in Säugerzellen
Als nächsten Schritt untersuchte Moritz Horn die Wirkung von GFAT-1 in Säugerzellen. Dafür lösten sie in Mauszellen die Bildung von schädlichen Proteinaggregaten aus. Allerdings zeigte sich, dass in den Zellen, in denen GFAT-1 aktiviert war diese Aggregate stark verringert sind. „Das sind sehr vielversprechende Ergebnisse, die uns auf dem Weg zur Medikamentenentwicklung deutlich weiterbringen. Wir sind allerdings noch lange nicht am Ziel“, so Denzel.
Die Forschungsarbeit wurde in Kooperation mit Adam Antebi und Sarah Denzel vom Max-Planck-Institut für Biologie des Alterns und Ulrich Baumann vom Institut für Biochemie an der Universität zu Köln durchgeführt.
Erfahren Sie mehr über die Arbeit in der Forschungsgruppe Denzel.







