Forschung
Abteilung Antebi
Im Laufe der letzten Jahrzehnte sind mit Hilfe genetischer Modellorganismen mehrere evolutionär konservierte Signalwege identifiziert worden, welche den Alterungsprozess regulieren, darunter die Insulin/IGF- und mTOR-Signalwege, die mitochondriale Aktivität, Signale aus dem Fortpflanzungssystem und durch Ernährungseinschränkungen vermittelte Langlebigkeit. Unser Labor war und ist maßgeblich an der Aufklärung einiger der kritischen Hauptakteure dieser Signalwege beteiligt. In laufenden Projekten befassen wir uns unter anderem damit, wie die Nährstoff-Sensorwege, die metabolischen Signalwege und die Reproduktionswege die Regulierung der Lebensdauer beeinflussen.

Ein Großteil der Altersforschung hat sich auf wegspezifische Mediatoren konzentriert; ob die verschiedenen alterungsbezogenen Signalwege jedoch in gemeinsamen Regulatoren oder in gemeinsam genutzten Prozessen zusammenlaufen, bleibt im Großen und Ganzen eine offene Frage. Viele unserer aktuellen Projekte konzentrieren sich daher auf die Entschlüsselung konvergenter Mechanismen, um im Kern zu verstehen, was der Langlebigkeit zugrunde liegt, und um klinische Ziele zu identifizieren, die die Gesundheits- und Lebensspanne verlängern könnten. Dieser Forschungsschwerpunkt konzentriert sich auf 4 Hauptthemen:
Der Nukleolus als Konvergenzpunkt zur Regelung der Langlebigkeit
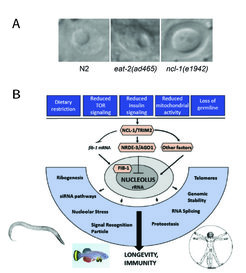
Unsere Gruppe hat entdeckt, dass der Nukleolus ein zentraler Konvergenzpunkt für die Regulierung der Langlebigkeit ist, und eine Reihe von Genen gefunden, die an der Regulierung der nukleolaren Größe und Funktion beteiligt sind. Wir haben entdeckt, dass kleine Nukleoli nicht nur bei C. elegans, sondern auch bei Fliegen, Fischen, Mäusen und vielleicht auch beim Menschen ein zellulares Markenzeichen für Langlebigkeit sind. Die Mechanismen, durch die der Nukleolus zur Alterung beiträgt, bleiben jedoch weiterhin unklar. Ein zentrales Forschungsthema unseres Labors besteht daher darin, zu klären, ob und wie sich verschiedene nukleolare Funktionen (z.B. Produktion und Biogenese von rRNA, Zusammenfügen verschiedener Ribonukleoproteinpartikel, Spleißfaktoren, siRNA-Wege) auf die Alterung auswirken.
Analyse der Auswirkungen des MYC-MONDO- und TFEB Transkriptionsnetzwerks auf die Lebensdauer
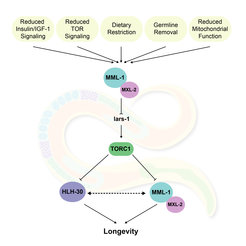
Wir haben ein umfangreiches Netzwerk aus Helix-Loop-Helix-(HLH)-Transkriptionsfaktoren entdeckt, das aus dem MML-1/MYC-MONDO-Komplex und HLH-30/TFEB besteht und für die Lebensverlängerung über mehrere Wege erforderlich ist. Dieses Netzwerk reguliert unter anderem weitgehend den Stoffwechsel von Lipiden, Kohlenhydraten, Aminosäuren, Aminen, Nukleosiden und Mitochondrien. Wie diese Prozesse tatsächlich mit der Lebensdauer zusammenhängen, muss jedoch noch geklärt werden. Unsere derzeitige Arbeit zielt daher darauf ab, Faktoren zu identifizieren, die das MYC-MONDO- und TFEB-Netzwerk regulieren.
Organellenkommunikation und ihre Rolle bei der Alterung
Unsere aktuellen Arbeiten zeigen, dass verschiedene Organellen (Mitochondrien, das endoplasmatische Retikulum, Nukleoli und Lysosomen) nicht nur selbstständig an der Alterung beteiligt sind, sondern dass auch die Kommunikation zwischen ihnen zur Immunität und Langlebigkeit beiträgt. Die Identifizierung der Faktoren, die diese Kommunikation vermitteln, und das Verständnis, wie Organellen zusammenarbeiten, um die Lebensspanne zu regulieren, ist ein wichtiger Schwerpunkt unserer laufenden Forschung.
Identifizierung von Metaboliten, die die Gesundheit und Lebensdauer von Tieren regulieren
Wir sind seit langem daran interessiert, zu verstehen, wie natürlich vorkommende Metaboliten als Signalmoleküle dienen können, um die Gesundheit und Lebensdauer von Tieren zu regulieren. Wir verwenden derzeit metabolomische Ansätze zur Identifizierung von Metaboliten, die die Langlebigkeit beeinflussen.
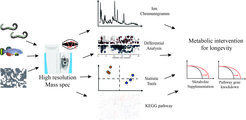
Darüber hinaus untersuchen wir aktiv verschiedene langlebige Ruhezustände (sogenannte Diapausen) und deren Zusammenhang mit der Alterung. Wir untersuchen sowohl die Dauerdiapause, die während des dritten Larvenstadiums von C.elegans auftritt, als auch die reproduktive Diapause (ARD). Letzteres ist ein Zustand welchen die Tiere als Reaktion auf den Nahrungsentzug im späten Larvenstadium einnehmen. Unsere derzeitige Arbeit konzentriert sich auf die Aufklärung der molekularen und physiologischen Wege, die die Dauerdiapause und die ARD steuern.





