Max-Planck-Forschungsgruppe Demetriades
Forschung
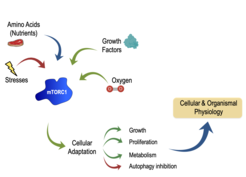
mTOR (mechanistic Target of Rapamycin) ist - in erster Linie als Teil des mTOR-Komplexes 1 (mTORC1) - ein Hauptregulator für Wachstum, Stoffwechsel, Sekretion und Autophagie. Die Bedeutung von mTORC1 für die Aufrechterhaltung der zellulären Homöostase wird dadurch unterstrichen, dass eine Vielzahl von Einflüssen auf diesen Komplex einwirkt, um das Wachstum zu regulieren. Nährstoffe, Energie und Wachstumsfaktoren aktivieren mTORC1, während verschiedene Stressfaktoren seine Aktivität stark hemmen (Abb. 1). Wichtig ist, dass mTORC1 nicht wie ein "Ein-Aus-Schalter" funktioniert, sondern eher wie ein fein abgestimmter Thermostat: Quantitative Schwankungen der mTORC1-Aktivität bestimmen das zelluläre Stoffwechsel- und damit auch das Wachstumsprogramm. Der unmittelbare Upstream-Aktivator von mTORC1 ist die kleine GTPase Rheb, deren Aktivität wiederum durch den hemmenden Tuberous Sclerosis Complex (TSC) reguliert wird. Eine Überaktivierung von mTORC1, die vor allem durch Mutationen an den vorgelagerten Regulatoren wie dem TSC verursacht wird, ist von klinischer Relevanz und ein häufiges Merkmal der meisten Krebsarten. Darüber hinaus werden Störungen der mTOR-Aktivität mit dem Altern, der Lebenserwartung und der Gesundheit in Verbindung gebracht. Der Rückgang des Immunsystems, Muskelschwund sowie der Beginn und das Fortschreiten zahlreicher altersbedingter, metabolischer (Diabetes) und neurologischer Erkrankungen (kognitiver Abbau, Alzheimer) werden zumindest teilweise durch eine gestörte mTOR-Funktion verursacht. Daher werden derzeit in der Klinik eine Reihe von pharmakologischen Hemmstoffen zur Behandlung von mTOR-bedingten Krankheiten eingesetzt, die auf Komponenten des mTOR-Netzwerks abzielen.
Unser Labor untersucht, wie Zellen ihr Wachstum in Gesundheit und Krankheit kontrollieren. Unsere Projekte zielen insbesondere darauf ab, zu verstehen:
- Wie wird das Zellwachstum in normalen Zellen reguliert?
- Wie trägt eine Fehlregulation zur Entwicklung altersbedingter Krankheiten bei?
- Wie erkennen Zellen das Vorhandensein oder Fehlen von Nährstoffen, um ihr Wachstum zu regulieren?
- Wie werden Informationen aus mehreren verschiedenen Signalen integriert, um TSC/mTORC1 zu regulieren?
- Wie werden diese Proteinkomplexe räumlich, zeitlich und gewebespezifisch reguliert?
Entschlüsselung des regulatorischen Netzwerks für Aminosäuren, das mTORC1 vorgeschaltet ist
Die Verfügbarkeit von Nährstoffen, wie z.B. Aminosäuren (AA), ist eine Voraussetzung für das Zellwachstum und daher ein robuster mTORC1-Regulator. Frühere Studien zur Regulierung von mTORC1 durch AAs haben sich hauptsächlich auf die lysosomalen Rag-GTPasen konzentriert und ein komplexes Proteinnetzwerk aufgebaut, das koordiniert AAs wahrnimmt, um die Rag-Aktivität zu verändern. Nach dem aktuellen Modell führt ein ausreichender AA-Gehalt zur Aktivierung von Rag, was wiederum mTORC1 an die lysosomale Oberfläche rekrutiert, wo sich auch sein direkter Aktivator Rheb befindet. Mehrere Aspekte der räumlich-zeitlichen mTORC1-Regulierung durch AAs sind jedoch noch nicht geklärt. Daher zielen viele unserer Projekte darauf ab zu verstehen, wie die Nährstoffverfügbarkeit Wachstum und Stoffwechsel über die TSC/mTORC1-Signalachse antreibt. Wir untersuchen sowohl die lysosomale Rag-abhängige AA-Sensing-Maschinerie als auch die Rag-unabhängigen Mechanismen, über die AAs mTORC1 regulieren, im Detail. Wir haben vor kurzem die Evolution der lysosomalen AA-Sensing-Maschinerie von der Hefe bis zum Menschen untersucht und die Bedeutung der strukturellen und funktionellen Diversifizierung der paralogen Rag-Gene in Säugetieren charakterisiert [siehe Gollwitzer et al., 2021 Nat Cell Biol]. Außerdem untersuchen wir die Wechselwirkungen zwischen verschiedenen Nährstoffquellen (Aminosäuren, Lipide, Zucker) bei der Regulierung von mTORC1 [siehe Nicastro, Brohée et al., 2021 bioRxiv]. Insgesamt zeigt diese Arbeit neue Mechanismen und Prinzipien der mTORC1-Aktivierung auf und erweitert damit unsere Sicht darauf, wie AAs und andere Nährstoffe die mTORC1-Aktivität steuern. Außerdem liefert sie neue mTORC1-Regulatoren, die als mögliche Ziele für die Entwicklung von Medikamenten gegen mTOR-bedingte Krankheiten in Frage kommen.
Signalintegration und lysosomale Relokalisierung des TSC-Komplexes
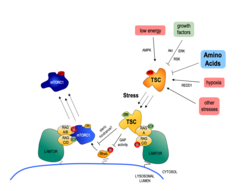
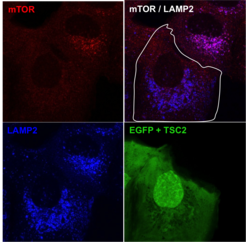
Der wichtigste vorgelagerte negative Regulator von mTORC1 ist der heterotrimere TSC-Proteinkomplex. Praktisch alle Upstream-Stimuli, die mTORC1 regulieren, einschließlich AAs, werden zumindest teilweise über den TSC signalisiert [siehe Demetriades et al., 2016 Nat Commun]. Daher fungiert der TSC/mTORC1-Hub als Integrationspunkt für Stresssignale und koordiniert die zelluläre Stressantwort (Abb. 2).
Unsere früheren Arbeiten haben die zellulären und molekularen Mechanismen aufgezeigt, durch die mTORC1 als Reaktion auf Aminosäuremangel inaktiviert wird. Wenn Zellen Aminosäuren fehlen, wird TSC von den Rag GTPasen schnell an die lysosomale Oberfläche rekrutiert, um auf sein Ziel Rheb einzuwirken und so die Lokalisierung und Aktivität von mTORC1 zu beeinflussen. Diese Arbeit brachte TSC in den AA-Sensing-Weg und zeigte, dass AA-Starvation mTORC1 über Veränderungen in der subzellulären Lokalisierung von TSC inaktiviert [see Demetriades et al., 2014 Cell] (Abb. 3).
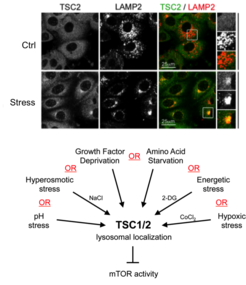
In einer Folgestudie konnten wir zeigen, dass die lysosomale Relokalisierung von TSC eine universelle Reaktion auf zellulären Stress ist. Jeder einzelne Stressreiz, der auf die Zellen einwirkt, reicht aus, um die lysosomale Rekrutierung von TSC zu bewirken und damit mTORC1 zu hemmen [siehe Demetriades et al., 2016 Nat Commun]. Der boolesche Operator für die lysosomale Relokalisierung von TSC als Reaktion auf mehrere Stimuli ist daher der "OR"-Operator (Abb. 4). Auf diese Weise stellen die Zellen sicher, dass mTORC1 unter ungünstigen Bedingungen inaktiv wird, um das Wachstum zu stoppen und so eine Stoffwechselkatastrophe und letztlich den Zelltod zu verhindern. Ein wichtiger, aber wenig verstandener Stressreiz ist hyperosmotischer Stress. Deshalb haben wir uns auch auf die Signalereignisse konzentriert, durch die osmotischer Stress mTORC1 inaktiviert, und den kompletten Signalweg zusammengestellt, an dem mehrere Kinasen beteiligt sind, die auf TSC2 einwirken und seine Lokalisierung regulieren [siehe Demetriades et al., 2015 Sci Rep]. Unsere frühere Arbeit zusammen mit dem Teleman-Labor hat auch die Rolle von Tsc2 und die räumliche Verteilung der TORC1-Aktivität in einem sich entwickelnden Organ von Drosophila aufgezeigt und eine Rolle dieser Maschinerie bei der Wundheilung nahegelegt [siehe Romero-Pozuelo et al., 2017 Dev Cell]. Kürzlich entdeckten wir zusammen mit unseren Kooperationspartnern zwei neue Faktoren, die die lysosomale Rekrutierung des TSC und die Inaktivierung von mTORC1 steuern: die mit Stressgranulaten verwandten G3BP1/2-Proteine, die mit TSC2 interagieren [siehe Prentzell et al., 2021 Cell]; und die lysosomalen PIP2-Phospholipide, die den TSC-Komplex über TSC1 verankern [siehe Fitzian et al., 2021 Mol Cell]. Zusammengenommen haben diese Projekte die qualitativen und quantitativen Aspekte aufgedeckt, wie mehrere vorgelagerte Stimuli mechanistisch integriert werden, um das Zellwachstum auf räumlich-zeitliche Weise zu regulieren.
mTOR steuert sekretorische Pfade, um das extrazelluläre Proteom neu zu gestalten
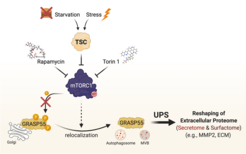
Kürzlich haben wir den TSC/mTORC1-Knotenpunkt als Haupt Steuerungspunkt der unkonventionellen Proteinsekretion (UPS) über die Phosphorylierung von GRASP55 im Golgi identifiziert [siehe Nüchel et al., 2021 Mol Cell] (Abb. 5). Wir konnten zeigen, wie Zellen ihr extrazelluläres Proteom umgestalten, um sich an verschiedene zelluläre Stressreize anzupassen, und damit die biologische Rolle der USV unterstreichen. Bemerkenswert ist, dass wir mTORC1 als den ersten Signalweg identifiziert haben, der die USV reguliert und damit die physiologischen Nährstoff-/Stresssignale mit der zellulären Stressreaktion verknüpft; außerdem haben wir GRASP55 als direkten Golgi-basierten Effektor von mTORC1 identifiziert und damit eine physiologische Rolle für mTORC1 in dieser Organelle aufgezeigt. Schließlich haben wir wichtige Einblicke in die Zellbiologie von UPS gewonnen und gezeigt, wie mTORC1 und GRASP5 das Sekretom und „Surfactom“ bei Stress verändern.
Unsere aktuelle Forschung knüpft an unsere früheren Erkenntnisse an und zielt darauf ab, die molekularen Mechanismen der zellulären Wachstumskontrolle und die Regulierung der TSC/mTOR-Achse zu erhellen. Sie konzentriert sich auf die Bereiche mTOR-Signalübertragung, Nährstoffsensorik, TSC-Biologie und Sekretions-/ECM-Biologie und deckt damit wichtige Aspekte der Grundlagen- und der translationalen Forschung ab. Unser Ziel ist es, das Arsenal an Medikamenten zur Bekämpfung von mTOR-Erkrankungen und zur Bekämpfung des Alterns um neue Ziele zu erweitern.




