Forschung
Max-Planck-Forschungsgruppe Scheiblich
Die normale Alterung des Gehirns und neurodegenerative Erkrankungen weisen gemeinsame pathologische Merkmale auf, wie z. B. den Verlust des Gehirnvolumens und den Rückgang der kognitiven Fähigkeiten infolge von Entzündungen. Während die Mechanismen, die an altersbedingten, entzündungsgetriebenen Veränderungen im Gehirn beteiligt sind, noch schlecht verstanden werden, scheint die Aktivierung von Mikroglia eine wesentliche Komponente zu sein.
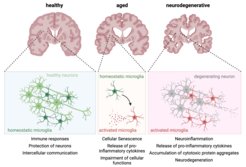
Als die primären angeborenen Immunzellen des Gehirns tragen Mikroglia zur zerebralen Homöostase bei, indem sie Veränderungen in ihrer unmittelbaren Umgebung wahrnehmen, Zelltrümmer beseitigen, Neurotrophine bereitstellen und Neuronen vor übermäßiger Aktivierung schützen. Mikroglia sind äußerst dynamische und reaktionsfähige Zellen, die prompt auf homöostatische Veränderungen reagieren. Diese Veränderungen können die Funktion der Mikroglia von 'Reinigungskräften' zu adaptiven Reagierenden umschalten. Altersbedingte Veränderungen können diese Mikroglia-Funktionen jedoch dramatisch beeinträchtigen und Mikroglia in die zelluläre Seneszenz überführen. Der altersbedingte Phänotyp der Seneszenz ist durch tiefgreifende Veränderungen ihrer zellulären Funktionen gekennzeichnet, die sowohl ihre Haushalts- als auch ihre Verteidigungsaufgaben beeinträchtigen. Zudem erwerben seneszente Mikroglia ein spezifisches pro-inflammatorisches seneszenz-assoziiertes Sekretionsprofil, das neuronale Funktionen wie Informationsspeicherung, Gedächtnisbildung und neuronale Regeneration beeinflussen kann. Ein Ungleichgewicht im entzündlichen Feinabstimmungsmechanismus kann zu Erkrankungen des Zentralnervensystems führen und den normalen Alterungsprozess in ein gefährliches Szenario chronischer Entzündungen umwandeln, bei dem Neurodegeneration auftreten kann.
Das Hauptziel unserer Gruppe ist es, die Mechanismen innerhalb der Mikroglia zu verstehen, die die zerebrale Homöostase und die Abweichungen während des Alterns, neurodegenerativer Zustände und anderer Gehirnerkrankungen regulieren. Unsere Forschung legt einen bedeutenden Schwerpunkt darauf, die grundlegenden Prinzipien der Interaktionen zwischen Mikroglia und Neuronen aufzudecken. Das Verständnis dieser Interaktionen ist entscheidend, da sie nicht nur eine wichtige Rolle beim normalen Altern, sondern auch beim Fortschreiten neurodegenerativer Krankheiten spielen.
Interzelluläre Kommunikation über Tunneling Nanotubes
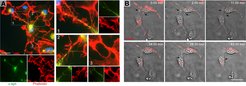
Die Mechanismen, die zur Alterung des Gehirns beitragen, sind weitgehend unbekannt. Möglicherweise handelt es sich jedoch um eine Rückkopplungsschleife aus mehreren interagierenden zellulären und molekularen Ereignissen, die zu einer weniger effizienten Kommunikation zwischen den Gehirnzellen führt. In diesem Zusammenhang haben wir vor kurzem einen Mechanismus entdeckt, bei dem Mikroglia Tunneling Nanotubes (TNTs) bilden, zelluläre Ausstülpungen, die entfernte Zellen mit anderen Gehirnzellen (Neuronen und Mikroglia) verbinden, die unter der Ansammlung zytotoxischer Proteinaggregate leiden. Wir fanden heraus, dass die Bildung von interzellulären TNTs die Umverteilung von zytotoxischen Proteinaggregaten auf weniger belastete benachbarte Mikroglia ermöglicht und so den Proteinabbau unterstützt (PMID: 34555357). Bemerkenswerterweise beobachteten wir bei der Co-Kultivierung von belasteten Zellen (Neuronen und Mikroglia) mit naiven Mikroglia den horizontalen Transfer funktioneller, intakter Mitochondrien von Mikroglia in belastete Zellen, was den oxidativen Stress erheblich reduzierte und die zelluläre Gesundheit in den Empfängern erhöhte. Dieser Mechanismus zielt darauf ab, belastete Zellen von ihrer funktionellen Beeinträchtigung zu befreien und das Überleben der Zellen zu verbessern. Ein Zusammenbruch dieses Prozesses und eine Unterbrechung der TNT-Bildung zwischen Mikroglia und benachbarten Zellen, z. B. aufgrund von Hirnalterung oder entzündlichen Ereignissen, kann vermutlich die Pathologie verschlimmern und zu übermäßiger zellulärer Dysfunktion und Zelltod führen. Eines unserer Ziele ist es, die Mechanismen zu verstehen, die die TNT-Bildung im Gehirn steuern, und ihre Bedeutung für die Aufrechterhaltung der Gehirnhomöostase zu definieren.
Neuroinflammation und zelluläre Seneszenz
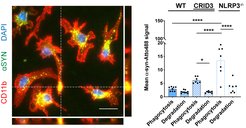
Ein Kennzeichen der Gehirnalterung ist das Auftreten von Entzündungen. Hinweise auf solche Entzündungen finden sich nicht nur bei Patienten, die an neurodegenerativen Erkrankungen leiden, sondern auch bei gesunden älteren Menschen. Es handelt sich um einen chronischen Entzündungszustand (zelluläre Seneszenz), der mit der dysregulierten Induktion von Entzündungswegen wie dem NLRP3-Inflammasom-Signalweg (PMID: 37278117 und PMID: 34507948 und PMID: 31748742), der anhaltenden Freisetzung entzündungsfördernder Moleküle und der Unfähigkeit zur Proliferation von Zellen wie Mikroglia verbunden ist. Interessant ist, dass diese chronische Neuroinflammation mit der Beeinträchtigung einer angemessenen Mikrogliafunktion korreliert, die ihre Phagocytose- und Abbaukapazitäten beeinträchtigt, was zu einer Anhäufung von beschädigten Zelltrümmern und zytotoxischem Material im Gehirn führt. Außerdem werden neurotoxische Faktoren freigesetzt, die ein ungünstiges Umfeld für Neuronen schaffen und das Risiko für neurodegenerative Prozesse erhöhen. Eines unserer Ziele ist es, die Auswirkungen altersbedingter Entzündungen auf die Funktionen der Mikroglia zu untersuchen, z. B. auf die Phagozytose und den Abbau von aufgenommenem Material, die Freisetzung von Entzündungsmediatoren (Zytokine/Chemokine), die Funktion der Mitochondrien sowie die TNT-Bildung und den Ladungstransfer zwischen miteinander verbundenen Zellen. Das Verständnis des Zusammenhangs zwischen Entzündung und Beeinträchtigung der Mikroglia ist entscheidend für die Entschlüsselung der Rolle dieser Zellen bei verschiedenen altersbedingten neurologischen Störungen.


