Forschung
Forschungsgruppe Matić

ADP-Ribosylierung (ADPr) ist eine vielseitige Post-Translationale-Modifikation (PTM), die bei vielen physiologischen und pathologischen Prozessen eine entscheidende Rolle spielt, von der DNA-Schadensreaktion (DDR) und Krebs bis hin zu neurologischen Erkrankungen und Alterung. ADP-Ribose wird durch die Wirkung verschiedener Transferasen, vor allem PARPs und Sirtuine, an verschiedene Aminosäuren auf Zielproteinen angehängt. Beide Enzymfamilien verwenden NAD+ als Substrat und regulieren so den NAD+-Stoffwechsel. PARP1, die wichtigste DNA-abhängige ADP-Ribosyltransferase und ein wichtiges Zielmolekül für die Krebstherapie, wurde im Rahmen der DDR eingehend untersucht und spielt eine wichtige Rolle in mehreren DNA-Reparaturwegen. Bei der Aktivierung von PARP1 werden in erster Linie ADP-Ribosylierungen am Protein selbst und an Histonen vorgenommen, was die Rekrutierung von DNA-Reparaturfaktoren am Chromatin fördert. DNA-Schäden verursachen eine Instabilität des Genoms und verändern das Epigenom der Zelle und sind eine Ursache für die Alterung von Organismen. Da PARP1 eine entscheidende Rolle in diesen Prozessen spielt, insbesondere im Zusammenhang mit Sirtuinen und dem NAD+-Stoffwechsel, hat es große Aufmerksamkeit auf sich gezogen. Trotz einer Fülle von Hinweisen auf die biomedizinische Bedeutung der ADP-Ribosylierung, insbesondere in Bezug auf DDR, Krebstherapie und Alterung, sind die molekularen Grundlagen von Signalwegen mit PARP1 und Sirtuinen schwer zu bestimmen. Insbesondere über die spezifische Rolle von Histon-ADPr ist bisher wenig bekannt, was größtenteils auf den Mangel an biochemischen Werkzeugen und Kenntnissen über die zugrunde liegenden molekularen Mechanismen zurückzuführen ist.
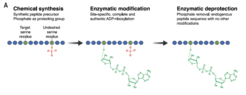
Aufgrund seiner chemischen Instabilität ist es sehr schwierig, ADPr auf molekularer Ebene zu untersuchen. Mithilfe modernster Proteomik haben wir Serin-ADPr als eine neue Art von PTM entdeckt, welche bei DNA-Schäden alle Histone betrifft (Leidecker et al. Nature Chemical Biology 2016). Bemerkenswerterweise war dieses wichtige zelluläre Signal ein halbes Jahrhundert lang unentdeckt geblieben, obwohl es sich inzwischen als wichtiges PTM erwiesen hat, das auf Tausende von Modifikationsstellen abzielt. Diese bahnbrechende Identifizierung von Ser-ADPr bereitete den Boden für unsere Entdeckung, dass HPF1 PARP1 so verändert, dass es die Serine an sich selbst, an Histonen und vielen anderen Proteinen modifiziert (Bonfiglio et al. Molecular Cell 2017). Kurz nach dieser Identifizierung des HPF1-PARP1/2-Komplexes als "Schreiber" von Ser-ADPr haben wir ARH3 als dessen "Radiergummi" entlarvt (Fontana et al. eLife 2017) und gezeigt, dass Ser-ADPr die wichtigste Form von ADPr in der DDR ist (Palazzo et al. eLife 2018).
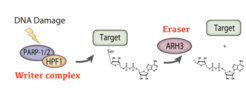
Seit 2020 ist Ser-ADPr durch HPF1/PARP1 zu einem intensiv erforschten Gebiet geworden, das für die Entwicklung von Krebsmedikamenten von großer Bedeutung ist. Trotz dieses starken und wachsenden Interesses an Ser-ADPr wurden weitere Fortschritte durch einen Mangel an biochemischen Werkzeugen und Ansätzen behindert. Um dieses Problem anzugehen, haben wir unsere Entdeckung von Ser-ADPr durch PARP1/HPF1 in einen leistungsstarken chemisch-biologischen Ansatz umgewandelt, der ein konkurrierendes PTM zur "Steuerung" der enzymatischen Reaktion nutzt (Bonfiglio et al. Cell 2020). Mit dieser Phopho-gesteuerten Strategie konnten wir die ersten ortsspezifischen ADPr-Antikörper sowie empfindliche Breitband-Mono-ADPr-Antikörper herstellen. Dank dieser neuartigen Werkzeuge machten wir eine weitere, höchst unerwartete Entdeckung: Bei DNA-Schäden werden PARP1-Ziele, vor allem Histone, überwiegend mono-ADP-ribosyliert. Während man jahrzehntelang davon ausging, dass das einzige Ergebnis der PARP1-Signalgebung poly-ADPr ist, konnten wir zeigen, dass die poly-ADPr-Hydrolase PARG das transiente Polymer zurück zu mono-ADPr abbaut, das dann vorherrschend in der DNA-Schadensantwort bleibt.
Durch die Anwendung der SpyTag-Technologie können wir jetzt selbst geringe Mengen von ADPr in einer Vielzahl von Anwendungen nachweisen und sogar Modifikationsereignisse in Echtzeit in lebenden Zellen verfolgen (Longarini et al. Mol Cell 2023). Mit diesen neuen Werkzeugen konnten wir zeigen, dass Mono-ADPr im Chromatin (vor allem in Histonen) die zweite Welle der PARP1-Signalisierung bei der DNA-Schadensreaktion darstellt und dass HPF1 PARP1 in Zellen in eine Mono-ADP-Ribosyltransferase umwandelt. Um das Konzept der PARP1-katalysierten Mono-ADPr als wichtigen Träger biologischer Informationen zu validieren, haben wir drei komplementäre Proteomik-Ansätze kombiniert, um eine Reihe interessanter Leser von Histon-Mono-ADPr zu identifizieren. Wir haben uns auf einen dieser Leser, die Ubiquitin-Ligase RNF114, konzentriert und gezeigt, dass Serin-Mono-ADPr als Rekrutierungssignal fungiert, um die DNA-Schadensreaktion und die Telomererhaltung zu modulieren.
Aufbauend auf diesen bahnbrechenden Entdeckungen und durch die Kombination unserer fortschrittlichen proteomischen/chemischen Strategien mit traditionellen biochemischen und zellulären Ansätzen wollen wir unser funktionelles und mechanistisches Verständnis darüber vertiefen, wie ADPr die DNA-Reparatur und den Alterungsprozess reguliert. Auf der Grundlage der überraschenden Prävalenz von mono-ADPr bei DNA-Schäden testen wir derzeit die Hypothese, dass Ser-mono-ADPr die Rekrutierung von Proteinen an den Stellen von DNA-Schäden reguliert. Die Rekrutierung von DNA-Reparaturfaktoren an Chromatin ist seit langem als eines der wichtigsten funktionellen Ergebnisse von PARP1-abhängigen Signalwegen bekannt. Sie wurde jedoch immer dem Poly-ADPr zugeschrieben, während das Mono-ADPr vernachlässigt wurde und jahrzehntelang praktisch "unsichtbar" war. Um die funktionellen Folgen von Serin-Mono-ADPr zu ermitteln, wollen wir nun die "Leser" von Histon-Mono-ADPr identifizieren und charakterisieren, indem wir modernste quantitative Massenspektrometrie anwenden und den Anwendungsbereich unserer chemischen Biologiestrategie erweitern.
Insgesamt zielt unsere Forschung darauf ab, die molekularen Mechanismen zu entschlüsseln, durch die Histon-ADPr altersbedingte biologische und krankheitsbedingte Prozesse reguliert, wobei wir uns auf spezifische Ser-ADPr-Markierungen und die neue Möglichkeit von Mono-ADPr als Schlüsselregulator der DNA-Reparatur konzentrieren.