Forschung
Max-Planck-Forschungsgruppe Panier
RNA-abhängige DNA-Schadensreaktionen
Unser erster Forschungsschwerpunkt konzentriert sich auf einen aktuellen Paradigmenwechsel im Bereich der Genomstabilität, nämlich die Erkenntnis, dass die Ereignisse, die an geschädigtem Chromatin zur Reparatur von DNA-Läsionen stattfinden, von RNA und RNA-bindenden Proteinen abhängig sind.
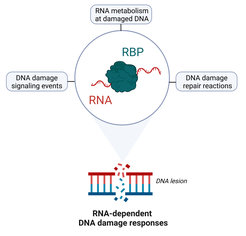
Während viele RNA-bindende Proteine gut charakterisierte Rollen bei der Anpassung der Genexpression als Reaktion auf genotoxischen Stress haben, wird immer deutlicher, dass diese Proteine auch nicht-kanonische Funktionen bei der DNA-Schadensreaktion haben, die weit über Transkription, Spleißen und mRNA-Verarbeitung hinausgehen (Abbildung 1). Wir verwenden eine Vielzahl von zellbiologischen und Omics-Ansätzen, um zu verstehen
- wie RNA-bindende Proteine zur Verarbeitung, Stabilisierung und Regulierung von RNAs im Kontext von geschädigtem Chromatin an großen DNA-Läsionen (d. h. Nukleotid-Exzisionsreparatur) und an DNA-Doppelstrangbrüchen beitragen.
- Wie dies die Erkennung von DNA-Schäden, die Signalübertragung und die Reparatur dieser Arten von Läsionen erleichtert.
- ob und wie die Fehlfunktion spezifischer RNA-bindender Proteine die Instabilität des Genoms und die zelluläre Seneszenz in einem physiologischen Kontext, z. B. bei Neuronen, fördert.
Telomere
Unser zweiter Forschungsschwerpunkt untersucht, wie zelluläre Mechanismen, die sich mit Replikationsstress und der Reparatur von DNA-Doppelstrangbrüchen befassen, mit den Mechanismen interagieren, die die Stabilität und Funktion der Telomere gewährleisten.
Telomere sind für die Stabilität des Genoms von entscheidender Bedeutung, da sie die Chromosomenenden vor dem Abbau und der Verschmelzung durch zelluläre DNA-Reparaturprozesse schützen. In nicht bösartigen somatischen Zellen verkürzen sich die Telomere nach der DNA-Replikation allmählich, was schließlich zur replikativen Seneszenz und zum checkpoint-gesteuerten Zelltod führt - ein Phänomen, das eine Schlüsselrolle bei der Alterung des Organismus spielt. Im Gegensatz dazu sind Tumorzellen in der Lage, der Telomerabnutzung entgegenzuwirken und somit replikative Unsterblichkeit zu erlangen, indem sie entweder Telomerase reexprimieren oder eine alternative Verlängerung der Telomere (ALT) induzieren, die auf Telomere-Rekombination beruht.

Vor kurzem haben wir das Protein SLX4IP als einen neuen Regulator der Genomerhaltung in menschlichen Zellen identifiziert. Wir fanden heraus, dass SLX4IP speziell an ALT-Telomeren angereichert ist, wo es entscheidend für die Kontrolle der DNA-Schadensreaktionsmaschinerie ist, die die Telomer-Rekombination fördert (Panier et al. Mol Cell 2019) (Abbildung 2).
Wir wollen verstehen:
- wie SLX4IP mit der Replikationsstress-Reaktionsmaschinerie interagiert, die an ALT-Telomeren hyperaktiv ist (Abbildung 2)
- ob und wie dieses Protein und seine assoziierten Faktoren die Genomstabilität auch an nicht-telomeren Loci und in Nicht-ALT-Zellen sicherstellen
- wie ihre Funktionsstörung zu durch Genominstabilität ausgelösten und altersbedingten Krankheiten beitragen kann

