Forschung
Max-Planck-Forschungsgruppe Huppertz
Während Transkriptionsveränderungen schon seit vielen Jahrzehnten die Aufmerksamkeit der Wissenschaft auf sich ziehen, stehen RNA-bindende Proteine (RBPs) erst seit kurzem als Regulatoren des Stoffwechsels im Mittelpunkt. RBPs sind eine vielseitige Gruppe von Proteinen, die kurz- und langfristige Stoffwechselanpassungen von Zellen, die sich teilen und differenzieren, ermöglichen können. Darüber hinaus können RBPs metabolische Stimuli integrieren, z. B. durch posttranslationale Modifikationen, Veränderungen der Lokalisierung oder der Verfügbarkeit von Metaboliten. Unser übergeordnetes Ziel ist es, das metabolisch dynamische System von ruhenden und aktivierten NSCs während der Alterung zu nutzen, um die folgenden Fragen zu klären und die Beteiligung von kanonischen und nicht-kanonischen RBPs daran zu entdecken:
- Was reguliert die metabolischen Veränderungen, die alternde NSCs durchlaufen?
- Welche Rolle spielt der Stoffwechsel im Alterungsprozess von NSCs?
- Wie werden die zytosolischen und mitochondrialen Stoffwechselwege in alternden NSCs koordiniert?
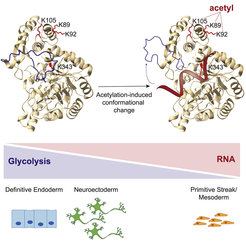
Ein Beispiel für ein kanonisches RBP, das die Stoffwechselvorgänge in der Zelle beeinflusst, ist YBX3. Durch die Bindung an die 3'-untranslatierte Region stabilisiert YBX3 das Transkript des Aminosäuretransporters SLC7A5 und verändert dadurch indirekt die Verfügbarkeit von großen, neutralen Aminosäuren in der Zelle (Cooke et al., 2019). Darüber hinaus wurde festgestellt, dass viele wichtige Stoffwechselenzyme in verschiedenen Zelltypen und Organismen RNA binden. Man kann sich zwei vereinfachte Arten von RNA-Enzym-Interaktionen vorstellen. Einerseits könnten Stoffwechselenzyme als RBPs fungieren und das Schicksal ihrer Ziel-RNAs regulieren. Andererseits könnte die RNA diese Enzyme regulieren, wie wir es kürzlich für das glykolytische Enzym Enolase beschrieben haben (Huppertz et al., 2022; Abbildung 1). Diese sehr große Klasse von nicht-kanonischen RBPs könnte eine neue Ebene der Stoffwechselregulierung bilden.
Unser Ziel ist die Entwicklung eines kombinatorischen Werkzeugs für die Klassifizierung alternder NSCs unter Verwendung genetisch kodierter, FRET-basierter Sensoren für Schlüsselmetabolite. Die leistungsstarke RNA-Interaktom-Erfassungsmethode (Perez-Perri et al., 2018) wird die globale Identifizierung von Proteinen ermöglichen, die in Zellen mit verschiedenen Stoffwechselprofilen unterschiedlich mit RNA assoziiert sind. Proteine mit strark verändertem RNA-Bindungspotenzial werden, wenn möglich, mit CRISPR/Cas9 ausgeschaltet und die Zellen werden einer transkriptomischen und metabolischen Untersuchung unterzogen. Die Ergebnisse dieser eingehenden zellulären Charakterisierung werden mit CLIP-Datensätzen von RBP-Kandidaten integriert, um ihre Rolle bei der Erstellung des Stoffwechselprofils alternder NSCs zu verstehen.
Der Stoffwechsel beeinflusst die Acetylierung und Methylierung von Histonen, was wiederum die RNA-Expressionslandschaft alternder NSCs verändert. Daher ist es wichtig, den Stoffwechselzustand und die globalen RNA-Expressionsprofile auf Einzelzellebene zu verknüpfen. Die Einzelzell-Transkriptomsequenzierung wird bei den FRET-Sensor-exprimierenden Zellen eingesetzt, um die RNA-Expressionsniveaus zu charakterisieren und sie direkt mit dem Stoffwechselzustand der Zelle zu verknüpfen. Dies ermöglicht die zeitliche Verfolgung von NSCs und die gleichzeitige Bewertung von Stoffwechselgradienten, wodurch heterogen exprimierte Marker aufgedeckt werden können, die für die Vorbereitung von Zellen auf ein bestimmtes altersbedingtes Schicksal relevant sind.
Die Arbeit an Enolase 1, einem nicht-kanonischen RBP, hat eine neue Welt der Stoffwechselregulierung aufgedeckt, die das Potenzial hat, universell zu sein. Daher werden wir einen Teil unserer Forschung der Untersuchung von nicht-kanonischen RBPs wie den mitochondrialen Enzymen des Tricarbonsäurezyklus und der Rolle widmen, die ihre RNA-Bindung bei der Koordination von Stoffwechselveränderungen im Rahmen des Alterungsprozesses spielen könnte.
